醫療制藥凈化工程
1、主要控制有生命微粒(細菌)與無生命微粒(塵埃)對工作對象的污染。其內部材料要
能經受各種滅菌劑侵蝕,且一般保證正壓。實質上就是其內部材料要能經受各種滅菌處理的
工業潔凈室。
2、其規劃及建造必須滿足GMP對藥品、食品、化妝品生產、包裝、貯存衛生的強制性要
求。從硬件上保證降低藥品、食品、化妝品生產過程中人為的錯誤;防止藥品、食品、化妝
品在生產過程中遭到污染或品質劣變;建立健全產品質保證體系。
例如:制藥工業、醫院(手術室、無菌病房)食品、化妝品、飲料產品生產、血站等。
醫療制藥凈化工程1、主要控制有生命微粒(細菌)與無生命微粒(塵埃)對工作對象的污染。其內部材料要能經受各種滅菌劑侵蝕,且一般保證正壓。實質上就是其內部材料要能經受各種滅菌處理的工業潔凈室。2、其規劃及建造必須滿足GMP對藥品、食品、化妝品生產、包裝、貯存衛生的強制性要求。從硬件上保證降低藥品、食品、化妝品生產
醫療制藥凈化工程
1、主要控制有生命微粒(細菌)與無生命微粒(塵埃)對工作對象的污染。其內部材料要
能經受各種滅菌劑侵蝕,且一般保證正壓。實質上就是其內部材料要能經受各種滅菌處理的
工業潔凈室。
2、其規劃及建造必須滿足GMP對藥品、食品、化妝品生產、包裝、貯存衛生的強制性要
求。從硬件上保證降低藥品、食品、化妝品生產過程中人為的錯誤;防止藥品、食品、化妝
品在生產過程中遭到污染或品質劣變;建立健全產品質保證體系。
例如:制藥工業、醫院(手術室、無菌病房)食品、化妝品、飲料產品生產、血站等。
GB50457-2008《醫藥工業潔凈廠房設計規范》
藥品生產質量管理規范(2010 年修訂)
藥品生產質量管理規范(2010 年修訂)(衛生部令第 79 號)附錄I
服務領域:生物制品(口服制劑、免疫試劑、創傷用品),藥品生產(針劑、片劑、膠囊、外用藥品、中藥)等。
重點注意事項:
1、人員凈化
1-1、人員凈化:生物醫藥潔凈室(區)的人員凈化程序宜按下圖布置
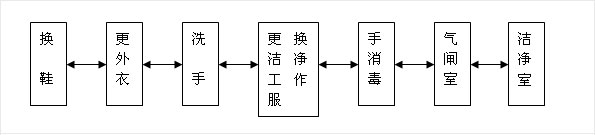
1-2、醫藥潔凈區域的入口應設置氣閘室;氣閘室的出入門應設置互鎖裝置。
1-3、空氣潔凈等級相同的無菌潔凈室和非無菌潔凈其人員凈化用室應分別設置。
2、物料凈化
2-1、醫藥潔凈室的原輔物料、包材出入口,應設置物料凈化用室。
2-2、進入無菌潔凈室的原輔料、包材除滿足以上要求外,尚應在出入口設置物料滅菌室和滅菌設施。
2-3、物料清潔室或滅菌室與醫藥潔凈室之間,應設置氣閘室或傳遞柜。
2-4、10萬級及以上區域工作服應在潔凈室內洗滌、干燥、整體,必要時應按要求滅菌。
3、醫藥潔凈室空氣潔凈等級
潔凈度級別 | 懸浮粒子最大允許數立方米 | |||
靜態 | 動態 | |||
≥0.5μm | ≥5.0μm | ≥0.5μm | ≥5.0μm | |
A級 | 3520 | 20 | 3520 | 20 |
B級 | 3520 | 29 | 352000 | 2900 |
C級 | 352000 | 2900 | 3520000 | 29000 |
D級 | 3520000 | 29000 | 不作規定 | 不作規定 |

公司地址:廣州市南沙區萬頃沙鎮工業路36號
聯系電話:020-39004904
聯系傳真:020-39004904
公司郵箱:806878308@qq.com

掃碼關注公眾號

網站二維碼


 規劃咨詢
規劃咨詢